الصيغة الجزيئية والهيكلية للفينول
الفينولات هي الاسم الشائع للكحول العطري. من خلال ممتلكاتهم، والمواد هي الأحماض الضعيفة. من الأهمية العملية الكبيرة العديد من مثيلات هيدروكسي بنزين C6H50H (صيغة الفينول) - أبسط ممثل للفئة. فلنتطرق إلى ذلك بمزيد من التفصيل.
الفينولات. الصيغة العامة والتصنيف
الصيغة العامة للمواد العضوية المتعلقةالكحول العطري، - R-أوه. تتشكل جزيئات الفينول والكريسولات السليم من قبل الراديكالي - فينيل C6H5، الذي يرتبط به واحد أو عدة مجموعات هيدروكسيل أوه (مجموعات هيدروكسي) مباشرة. من خلال عددها في جزيء، يتم تصنيف الفينولات إلى مفردة، مزدوجة ومتعددة الذرات. المركبات الفطرية من هذا النوع هي الفينول والكريسول. وأكثرها شيوعا بين هيدروكسي البنزين المتعدد الهيدروجين هي النفثول، التي تحتوي على نويتين مكثفتين في تكوينهما.

الفينول هو ممثل للكحول العطرية
كان الفينول معروف بالفعل لعمال النسيج بالفعل في القرن الثامن عشر: استخدم النساجون كصبغ. في التقطير من قطران الفحم في عام 1834، الكيميائي الألماني F. رونج بلورات متميزة من هذه المادة مع رائحة حلوة مميزة. الاسم اللاتيني للفحم هو كاربو، لذلك كان يسمى مجمع حمض الكربوليك (حمض الكربوليك). فشل الباحث الألماني في تحديد تكوين المادة. تم إنشاء الصيغة الجزيئية للفينول في عام 1842 من قبل O. لوران، الذي يعتبر مشتق الكربولي من البنزين. للحمض الجديد يستخدم اسم "فينيل". تشارلز جيرارد أن المادة هي الكحول، ويطلق عليه الفينول. مجالات التطبيق الأولية للمركب هي الطب، دباغة الجلود، وإنتاج الأصباغ الاصطناعية. خصائص المادة:
- الصيغة الكيميائية العقلانية - C6H5OH.
- الوزن الجزيئي للمركب هو 94.11 أ. ه.
- الصيغة الإجمالية، التي تعكس تكوين، هو C6H6O.

التركيب الإلكتروني والمكاني لجزيء الفينول
اقترحت الصيغة الهيكلية الدورية للبنزينالكيميائي العضوي الألماني F. كيكيول في عام 1865، وقبله بقليل - I. لوسشميدت. ويمثل العلماء جزيئا من المادة العضوية في شكل مسدس منتظم مع تناوب بسندات بسيطة ومزدوجة. وفقا للأفكار الحديثة، والنواة العطرية هو نوع خاص من هيكل حلقة، ودعا "اتصال مترافق".
ستة ذرات الكربون C تخضع لعملية سب2- تهجين المدارات الإلكترونية. الغيوم P الإلكترون، التي لا تشارك في تشكيل C-C السندات، تتداخل فوق وتحت الطائرة من نواة الجزيء. هناك جزأين من السحابة الإلكترونية العامة، والتي تغطي الحلقة بأكملها. الصيغة الهيكلية للفينول يمكن أن تبدو مختلفة، نظرا للنهج التاريخي لوصف هيكل البنزين. وللتأكيد على الطبيعة غير المشبعة للهيدروكربونات العطرية، تعتبر ثلاث من السندات الستة تقليديا مزدوجة، تتخللها ثلاث منها بسيطة.
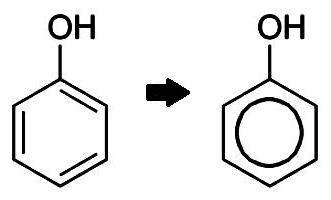
استقطاب السندات في مجموعة هيدروكسي
في أبسط الهيدروكربون العطرية - البنزين C6H6 - سحابة الإلكترون متناظرة. تختلف صيغة الفينول بواسطة مجموعة هيدروكسي واحدة. وجود الهيدروكسيل يعطل التماثل، وهو ما ينعكس في خصائص المادة. السندات بين الأكسجين والهيدروجين في مجموعة هيدروكسي هو التساهمية القطبية. تهجير زوج من الإلكترونات العامة إلى ذرة الأكسجين يؤدي إلى ظهور شحنة سالبة (تهمة جزئية) على ذلك. يحرم الهيدروجين من الإلكترون ويحصل على تهمة جزئية من "+". وبالإضافة إلى ذلك، الأكسجين في مجموعة O-H هو صاحب اثنين من أزواج الإلكترون أونشارد. واحدة منها تجذبها سحابة إلكترونية من النواة العطرية. لهذا السبب، يصبح السندات أكثر استقطابا، ذرة الهيدروجين هو أكثر سهولة استبدال المعادن. النماذج تعطي فكرة عن الطابع غير المتماثلة لجزيء الفينول.
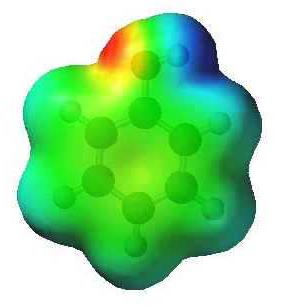
خصوصيات التفاعل بين الذرات في الفينول
سحابة إلكترونية واحدة من النواة العطرية فييتفاعل جزيء الفينول مع مجموعة الهيدروكسيل. هناك ظاهرة تسمى اقتران، ونتيجة لذلك يتم جذب زوج الطبيعي من الإلكترونات من ذرة الأكسجين من مجموعة هيدروكسي لنظام دورة البنزين. ويعوض النقصان في الشحنة السالبة عن استقطاب أكبر للسندات في مجموعة O-H.
جوهر العطرية أيضا يغير النظامالتوزيع الإلكتروني. أنه يقلل على الكربون، الذي يرتبط مع الأكسجين، ويرتفع بالقرب من أقرب ذرات في مواقع أورثو (2 و 6). الإقناع يسبب تراكم تهمة "-" عليها. مزيد من النزوح الكثافة - حركتها من الذرات في المواقف الفوقية (3 و 5) إلى الكربون في موقف شبه (4). صيغة الفينول لراحة دراسة الاقتران والتأثير المتبادل عادة ما يحتوي على ترقيم ذرات حلقة البنزين.

شرح الخصائص الكيميائية للفينول استنادا إلى هيكلها الإلكتروني
عمليات اقتران النواة العطرية وهيدروكسيل تؤثر على خصائص كل من الجسيمات و المادة بأكملها. على سبيل المثال، فإن كثافة الإلكترون العالية للذرات في مواقف أورثو وفقرة (2، 4، 6) يجعل الروابط C-H من الحلقة العطرية من الفينول أكثر تفاعلا. الشحنة السلبية من ذرات الكربون في المواقف الفوقية تنخفض (3 و 5). هجوم الجسيمات الكهربية في التفاعلات الكيميائية تتعرض للكربون، وتقع في أورثو وفقرة المواقف. في تفاعل بروميناتيون البنزين، تحدث التغييرات مع التدفئة القوية و وجود محفز. يتم تشكيل مشتق مونوهالوجينو - بروموبنزين. تسمح صيغة الفينول للمادة أن تتفاعل مع البروم على الفور تقريبا دون تسخين الخليط.
جوهر العطرية يؤثر على قطبية السندات فيمجموعة هيدروكسي، وزيادة ذلك. تصبح ذرة الهيدروجين أكثر قدرة على الحركة، بالمقارنة مع الكحول المحدود. الفينول يتفاعل مع القلويات، وتشكيل الأملاح الفينولية. الإيثانول لا تتفاعل مع القلويات، أو بالأحرى، والمنتجات رد فعل - ethanolates - تتحلل. كيميائيا، الفينولات هي أحماض أقوى من الكحول.
ممثلون عن فئة الكحول العطري
الصيغة الإجمالية لتاثيل الفينول-كريسول (ميثيلفينول، هيدروكسيتولوين) -C7H8O. المادة في المواد الخام الطبيعية غالبا ما يصاحب الفينول، وأيضا خصائص مطهرة. مثيلات الفينول الأخرى:
- بيروكاتيشين (1،2-هيدروكسي بنزين). الصيغة الكيميائية - C6H4(OH)2.
- ريسورسنول (1،3-هيدروكسي بنزين) -C6H4(OH)2.
- بيروجالول (1،2،3-تريهيدروكسي بنزين) -C6H3(OH)3.
- النفثول. الصيغة الإجمالية للمادة هي C10H7OH. يتم استخدامه في إنتاج الأصباغ والأدوية والمركبات عطرة.
- تيمول (2-إيزوبروبيل -5-ميثيلفينول). الصيغة الكيميائية - C6H3CH3(أوه) (C3H7). يتم استخدامه في الكيمياء من التوليف العضوي، والطب.
- فانيلين، بالإضافة إلى الراديكالية الفينولية، يحتوي على مجموعة استر الأثير وبقايا الألدهيد. الصيغة الإجمالية للمركب هي C8H8O3. يستخدم الفانيلين على نطاق واسع كعطر اصطناعي.
صيغة الكاشف للاعتراف بالفينولات
ويمكن إجراء التحديد النوعي للفينول معباستخدام البروم. نتيجة لرد فعل الاستبدال، راسب أبيض من ترسبروموفينول يترسب. بيروكاتيشين (1،2-هيدروكسي بنزين) ملون الأخضر في وجود كلوريد الحديديك المذاب. مع الكاشف نفسه، يتفاعل الفينول كيميائيا، و تريفينولات، التي لديها اللون الأرجواني، وتتكون. رد فعل نوعي على الريسورسنول هو ظهور تلوين البنفسجي الداكن في وجود كلوريد الحديديك. تدريجيا لون الحل يتحول إلى اللون الأسود. الصيغة كاشف، الذي يعمل على التعرف على الفينول وبعض من مثيلاتها، هو فيكل3 (كلوريد الحديديك).
هيدروكسي البنزين، نفثول، الثيمول كلها الفينولات. الصيغة العامة وتكوين المواد يجعل من الممكن لتحديد ما إذا كانت هذه المركبات تنتمي إلى سلسلة العطرية. جميع المواد العضوية التي تحتوي في صيغة لها فينيل جذري C6H5، والتي هي هيدروكسي مجموعات المستعبدين مباشرة،معرض خصائص خاصة. أنها تختلف عن الكحول في حموضة أعرب أفضل. بالمقارنة مع المواد من سلسلة مثلي من البنزين، والفينولات هي مركبات كيميائية أكثر نشاطا.
</ p>>







